近日,四川大学张大伟团队在Plant Cell 和EMBO J发表2篇研究论文,揭示植物碳饥饿后恢复的调控机制和揭示植物生长发育和抗病性平衡的调控机制。
在植物遭受胁迫时,植物的生长通常处于停滞状态。在胁迫后的恢复阶段,生长发育被重启。与专注于抗逆性的大量研究相比,有关植物在逆境后恢复的机制的报道相对较少,但这一机制至关重要,因为它决定了作物的最终产量。
BRI1-EMS-SUPPRESSOR1 (BES1)是油菜素内酯(Brassinosteroids,BRs)信号通路中的核心转录因子,主要通过影响BR响应基因表达来调控植物的生长发育。已有研究报道几种E3泛素连接酶调节BES1的稳定性,但对拮抗E3连接酶介导的泛素化以维持BES1的稳态的去泛素化过程仍然知之甚少。
2022年8月9日,The Plant Cell在线发表了四川大学张大伟教授团队题为“The deubiquitinating enzymes UBP12 and UBP13 positively regulate recovery after carbon starvation by modulating BES1 stability in Arabidopsis thaliana”的研究论文。该研究揭示了植物如何通过去泛素化酶UBP12和UBP13调控BES1蛋白丰度,在碳饥饿后的恢复阶段增强BR调控的生长,从而使植物快速恢复。

该研究发现去泛素化酶UBP12和UBP13可以与BES1相互作用。UBP12和UBP13从泛素化的BES1上去除泛素,以稳定磷酸化和去磷酸化形式的BES1。缺失UBP12和UBP13功能的双突变体ubp12 -2w ubp13 -3表现出BR缺失和BR不敏感表型,而过表达UBP12或UBP13的转基因植株表现出增强的BR响应。在碳饥饿后的恢复过程中, UBP12和UPB13的表达受到诱导,使受胁迫的植株BES1积累并快速恢复。
总之,该研究揭示了BES1在碳饥饿和碳饥饿后恢复过程中的动态调控机制(图1)。在胁迫条件下,SINATs和BAF1等E3泛素连接酶被激活,BES1被蛋白酶体降解并发生依赖于DSK2的自噬,从而减缓了植物的生长。在生长或恢复阶段,UBP12和UBP13的积累导致BES1的积累,从而促进植株生长和/或胁迫恢复。
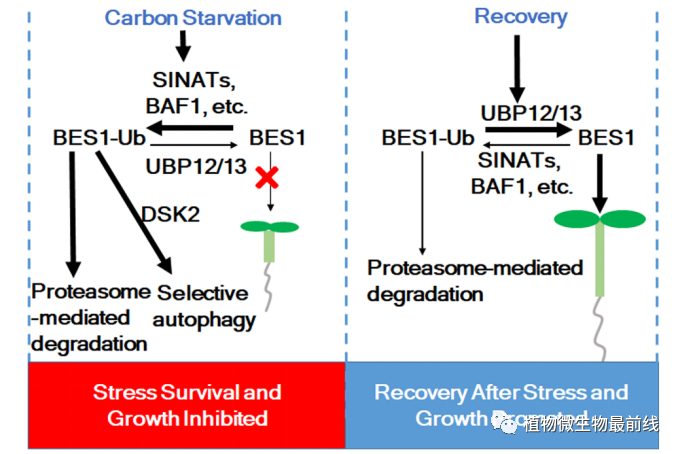
图1. UBP12和UBP13调控BES1的稳定性以响应碳饥饿和恢复的工作模型
70200app永利会员登录博士研究生熊佳威为本文第一作者,张大伟教授为通讯作者,四川大学林宏辉教授和美国爱荷华州立大学尹延海教授参与了部分工作。该研究得到了国家自然科学基金、四川省科技计划项目和中央高校基本科研业务费的资助。
植物的固着性使其不可避免的承受着复杂的环境胁迫,在其整个生长发育过程中,会不断的遭受各种各样的微生物病原体的攻击。植物防御激素水杨酸( Salicylic acid, SA)在植物免疫和系统获得性抗性中起着重要作用。细菌或病毒病原体会诱导 SA 产生,SA信号被其受体NPR1识别后,会诱导NPR1解聚进入细胞核,NPR1单体通过与TGAs转录因子形成复合体激活病程相关(PR)基因的表达,从而触发植物免疫响应。然而,病原体诱导水杨酸(SA)介导的病程相关(PR)基因表达的过程中,TGAs的功能是如何被调控的,影响TGAs活性的翻译后修饰机制尚不清楚。
2022年8月11日,四川大学张大伟教授团队在The EMBO Journal发表了题为“Salicylic acid-activated BIN2 phosphorylation of TGA3 promotes PR gene expression and disease resistance”的研究论文。该研究揭示了SA 信号如何通过类GSK3激酶BRASSINOSTEROID INSENSITIVE 2(BIN2)磷酸化TGA3激活植物免疫应答的过程,提出了BIN2整合BR信号与SA信号平衡植物生长与防御的新机制。

该研究发现BR信号通路的核心调控激酶 BIN2的功能增强型突变体bin2-1表现出持续性免疫应答,在正常情况下就能诱导PR基因高表达,并具有较强抗病性,而在BIN2功能缺失突变体bin2-3bil1bil2中病原体或SA不能诱导PR基因,表现出较强的感病性。通过互作蛋白筛选发现BIN2可以与 SA 信号通路的关键转录因子TGA3相互作用,并通过磷酸化TGA3的第33位丝氨酸调控其DNA结合能力和转录活性。病原体诱导的SA信号通过依赖于NPR1的形式激活BIN2的激酶活性,激活的BIN2又通过磷酸化TGA3促进NPR1-TGA3复合体的形成,通过此种正反馈调节作用实现免疫信号的级联放大,使植物获得抗病性。此外,作者还同时发现BIN2是介导BR信号和SA信号交叉互作的关键节点,BR和SA之间存在相互拮抗关系,SA可抑制BR介导的生长过程,而BR则可抑制SA诱导的PR基因表达,该过程受到BIN2激酶的调控。最后,该研究发现TGA3的33位丝氨酸可作为抗病作物分子育种的潜在靶点。
总之,该研究发现了 SA 信号通路中一个未知的分支,揭示了植物抵抗病原体免疫信号级联放大的全新途径。同时,揭示了植物通过类GSK3激酶BIN2整合BR介导的生长信号和SA介导的防御信号的新机制。
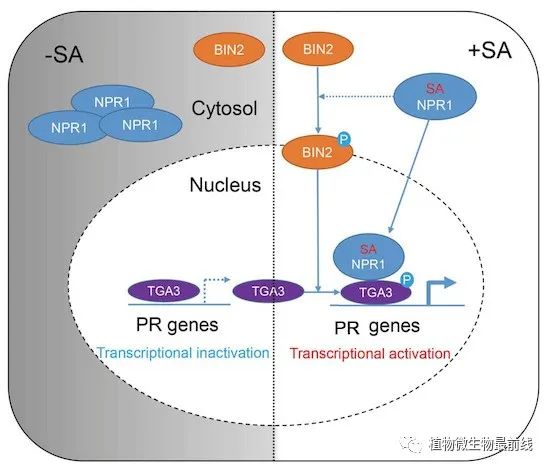
图1. BIN2-TGA3调控植物免疫应答的模型
四川大学张大伟教授为该论文的通讯作者,韩青博士和西南科技大学特聘副教授谭文荣博士为该论文的第一作者。四川大学赵雨晴硕士、杨峰博士和姚秀宏博士参与了部分工作。四川大学林宏辉教授给予了该研究大力支持。该研究得到了国家自然科学基金、四川省科技计划项目和中央高校基本科研业务费的资助。
